Bước vào năm học cuối cấp 2, có lẽ các bạn học sinh cũng đang cố gắng tăng tốc học xong chương trình để tiến hành ôn luyện thi lên lớp 10. Chính vì vậy, ngoài áp lực từ việc học 3 môn chính, các bạn học sinh còn phải cân bằng việc học trên lớp. Và để tạo thuận tiện cho các bạn học sinh trong quá trình ôn luyện cho kỳ thi sắp tới đó là kỳ thi giữa học kỳ 1, Newshop xin gửi đến các bạn Tài liệu Ôn tập lý thuyết hóa học lớp 9 kỳ 1 và Bộ đề thi giữa kì 1 Hóa 9 năm học 2022 - 2023 được biên soạn bám sát cấu trúc cùng nội dung thi trên lớp của các bạn học sinh lớp 9, từ đó hỗ trợ các em định hướng kiến thức, sắp xếp thời gian làm bài hợp lý nhằm đạt kết quả tốt nhất.
A. ÔN TẬP LÝ THUYẾT HÓA HỌC 9 KỲ 1
LÝ THUYẾT HÓA VÔ CƠ
CHƯƠNG I: CÁC LOẠI HỢP CHẤT VÔ CƠ
1. Tính chất hóa học của oxit
| Oxit axit | Oxit bazơ | |
| Tác dụng với nước |
Một số oxit axit + H2O → dung dịch axit (đổi màu quỳ tím → đỏ)
CO2 + H2O → H2CO3
Oxit axit tác dụng được với nước: SO2, SO3, N2O5, P2O5…
Không tác dụng với nước: SiO2,…
|
Một số oxit bazơ + H2O → dung dịch kiềm (đổi màu quỳ tím → xanh)
CaO + H2O → Ca(OH)2
Oxit bazơ tác dụng được với nước: Na2O, K2O, BaO,..
Không tác dụng với nước: FeO, CuO, Fe2O3,…
|
| Tác dụng với axit | Không phản ứng |
Axit + Oxit bazơ → muối + H2O
FeO + H2SO4 (loãng) → FeSO4 + H2O
|
| Tác dụng với bazơ kiềm |
Bazơ + Oxit axit → muối (muối trung hòa, hoặc axit) + H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
|
Không phản ứng |
| Tác dụng với oxit axit | Không phản ứng |
Oxit axit + Oxit bazơ (tan) → muối
CaO + CO2 → CaCO3
|
| Tác dụng với oxit bazơ |
Oxit axit + Oxit bazơ (tan) → muối
MgO + SO3 → MgSO4
|
Không phản ứng |
| Oxit lưỡng tính (ZnO, Al2O3, Cr2O3) | Oxit trung tính (oxit không tạo muối) NO, CO,… | |
| Tác dụng với nước | Không phản ứng | Không phản ứng |
| Tác dụng với axit | Al2O3 + 6HCl → 2AlCl3 + 3H2O | Không phản ứng |
| Tác dụng với bazơ | Al2O3 + 2NaOH → 2NaAlO2 + 3H2O | Không phản ứng |
| Phản ứng oxi hóa khử | Không phản ứng |
Tham gia phản ứng oxi hóa khử
2NO + O2
|
2. Tính chất hóa học của axit, bazơ
| Axit | Bazơ | |
| Chất chỉ thị | Đổi màu quỳ tím → đỏ |
đổi màu quỳ tím → xanh
Đổi màu dung dịch phenolphatalein từ không màu thành màu hồng
|
| Tác dụng với kim loại |
- Axit (HCl và H2SO4 loãng) + kim loại (đứng trước H trong dãy hoạt động hóa học) → muối + H2
Fe + 2HCl → FeCl2 + H2
|
Một số nguyên tố lưỡng tính như Zn, Al, Cr, …
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
|
| Tác dụng với bazơ |
Bazơ + axit → muối + nước
NaOH + HCl → NaCl + H2O
|
Một số bazơ lưỡng tính (Zn(OH)2, Al(OH)3, …) + dung dịch kiềm
Al(OH)3 + NaOH → NaAlO2 + 2H2O
|
| Tác dụng với axit |
Bazơ + axit → muối + nước
H2SO4 + NaOH → Na2SO4 + H2O
|
|
| Tác dụng với oxit axit | Không phản ứng |
Bazơ + oxit axit → muối axit hoặc muối trung hòa + nước
SO2 + NaOH → Na2SO3 + H2O
SO2 + NaOH → Na2HSO3 + H2O
|
| Tác dụng với oxit bazơ |
Axit +oxit bazơ → muối + nước
CaO + H2SO4 → CaSO4 + H2O
|
Một số oxit lưỡng tính như ZnO, Al2O3, Cr2O3,… tác dụng với dung dịch bazơ |
| Tác dụng với muối |
Axit + muối → muối mới + axit mới
HCl + AgNO3 → AgCl + HNO3
|
Bazơ + muối → Bazơ mới + muối mới
KOH + CuSO4 → K2SO4 + Cu(OH)2
|
| Phản ứng nhiệt phân |
Một số axit
H2SO4
|
Bazơ không tan
Cu(OH)2
|
3. Tính chất hóa học của muối
| Tính chất hóa học | Muối |
| Tác dụng với kim loại |
Kim loại + muối → muối mới + kim loại mới
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Điều kiện: Kim loại đứng trước (trừ Na, K, Ca,…) đẩy kim loại đứng sau (trong dãy hoạt động hóa học) ra khỏi dung dịch muối của chúng.
Kim loại Na, K, Ca… khi tác dụng với dung dịch muối thì không cho kim loại mới vì:
Na + CuSO4 →
2Na + H2O → NaOH + H2
CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
|
| Tác dụng với bazơ |
Muối + bazơ → muối mới + bazơ mới
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
|
| Tác dụng với axit |
Muối + axit → muối mới + axit mới
BaCl2 + AgNO3 → Ba(NO3)2 + AgCl
|
| Tác dụng với muối |
Muối + muối → 2 muối mới
BaCl2 + Na2SO4 → BaSO4 + NaCl
|
| Nhiệt phân muối |
Một số muối bị nhiệt phân hủy ở nhiệt độ cao
CaCO3
2KMnO4
|
CHƯƠNG 2: KIM LOẠI
1. Tính chất của Al và Fe
| Nhôm (Al) | Sắt (Fe) | |
| Tính chất vật lý |
- Là kim loại nhẹ, màu trắng, dẻo, có ánh kim, dẫn điện và dẫn nhiệt tốt.
- Nhiệt độ nóng chảy 6600C.
|
- Là kim loại nặng, màu trắng xám, dẻo, có ánh kim, dẫn điện, dẫn nhiệt tốt (kém Al).
- Nhiệt độ nóng chảy 15390C.
- Có tính nhiễm từ.
|
| Tính chất hóa học | < Al và Fe có tính chất hóa học của kim loại > | |
| Tác dụng với phi kim |
2Al + 3Cl2
4Al + 3O2
|
2Fe + 3Cl2
2Fe + 3Cl2
|
| Tác dụng với axit | 2Al + 6HCl → 2AlCl3 + 3H2 | Fe + H2SO4 → FeSO4 + H2 |
| Lưu ý: Al và Fe không phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội. | ||
| Tác dụng với dd muối | 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu | Fe + 2AgNO3 ↓ →Fe(NO3)2 + 2Ag |
|
Tính chất khác
Tác dụng với dd kiềm
|
nhôm + dd kiềm→ H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
|
|
| Trong các phản ứng: Al luôn có hóa trị III. | Trong các phản ứng: Fe có hai hóa trị: II, III. | |
| Hợp chất |
Al2O3 có tính lưỡng tính
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
|
FeO, Fe2O3 và Fe3O4 là oxit bazo không tan trong nước.
Fe(OH)2 ↓màu trắng
Fe(OH)3 ↓màu đỏ nâu
|
2. Hợp chất sắt: Gang, thép
| Hợp kim | Gang | Thép |
| Sắt với cacbon (2 – 5%) và một số nguyên tố khác như Si, Mn S. . | Sắt với cacbon (dưới 2%) và các nguyên tố khác như Si, Mn, S . | |
| Tính chất | Giòn (không rèn, không dát mỏng được) và cứng hơn sắt,. | Đàn hồi, dẻo (rèn, dát mỏng, kéo sợi được), cứng. |
| Sản xuất |
Trong lò cao
- Nguyên liệu: quặng sắt
- Nguyên tắc: CO khử các oxit sắt ở t0 cao.
- Các phản ứng chính:
Phản ứng tạo thành khí CO:
C + O2
C + CO2
CO khử oxit sắt có trong quặng:
Fe2O3 + 3CO
Fe nóng chảy hoà tan 1 lượng nhỏ
|
- Trong lò luyện thép.
- Nguyên liệu: gang, khí oxitắc: Oxi hóa các nguyên tố C, Mn, Si, S, P, … có trong gang.
- Các phản ứng chính
Thổi khí oxi vào lò có gang nóng chảy ở nhiệt độ cao. Khí oxi oxi hoá các nguyên tố kim loại, phi kim để loại khỏi gang phần lớn các nguyên tố C, Si, Mn, S . . .
Thí dụ: C + O2
Thu được sản phẩm là thép.
|
3. Dãy hoạt động hóa học của kim loại
Theo chiều giảm dần độ hoạt động của kim loại:
Li, K, Ba, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au
Lúc khó bà cần nàng may áo giáp sắt nên sang phố hàng đồng á hiệu phi âu.
Ý nghĩa dãy hoạt động hóa học của kim loại:
- Mức độ họat động hóa học của kim loại giảm dần từ trái qua phải.
- Kim loại đứng trước Mg (5 kim loại đầu tiên) tác dụng với nước ở điều kiện thường à kiềm và khí hiđro.
- Kim loại đứng trước H phản ứng với một số dd axit (HCl, H2SO4 loãng, …) và khí H2.
-
Kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch muối (trừ 5 kim loại đầu tiên
CHƯƠNG 3: PHI KIM
| Cl2 | C | |
| Tính chất vật lý | Clo là chất khí màu vàng lục. Rất độc, nặng gấp 2,5 lần không khí |
Có 3 dạng thù hình: kim cương, than chì, cacbon vô định hình.
-Có tính hấp phụ
|
| Tính chất hóa học | ||
| 1. Tác dụng với hiđro: | Cl2 + H2 → 2HCl | C + 2H2 |
| 2. Tác dụng với kim loại: |
2Fe + 3Cl2 → 2FeCl3
Cu + Cl2 → CuCl2
|
C + Ca |
| 3. Với oxi | Không phản ứng trực tiếp | C + O2 → CO2 |
| 4. Với nước | l2 + H2O ⇔HClO + HCl | C + H2O |
| 5. Với dung dịch kiềm | Cl2 + NaOH → NaClO + NaCl + H2O | Không phản ứng |
| 6. Với dung dịch muối | Cl2 + 2FeCl2 → 2FeCl3 | Không phản ứng |
| 7. Phản ứng oxi hóa khử | Clo thường là chất oxi hóa | CuO + C → CO2 + Cu |
| 8. Phản ứng với hidrocacbon | CH4 + Cl2 →CH3Cl + HCl | Không phản ứng |
| 9. Điều chế |
1. Trong phòng TN
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
2. Trong công nghiệp
2NaCl + 2H2O → Cl2 + H2 + 2NaOH (điện phân, có màng ngăn)
|
|
2. Tính chất của hợp chất cacbon
| Tính chất | Cacbon oxit (CO) | Cacbon đi oxit (CO2) |
| Tính chất vật lí |
CO là khí không màu, không mùi
CO là khí rất độc
|
CO2 là chất khí không màu, nặng hơn không khí
Khí CO2 không duy trì sự sống cháy
|
| Tính chất hóa học | ||
| 1. Tác dụng với H2O | Không phản ứng ứng ở nhiệt độ thường | CO2 + H2O ⇔ H2CO3 |
| 2. Tác dụng với dung dịch kiềm | Không phản ứng |
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
|
| 3. Tác dụng với hợp chất |
Ở nhiệt độ cao: CO là chất khử
3CO + Fe2O3 → 3CO2 + 2Fe
|
CO2 + CaO → CaCO3
|
| 4. Ứng dụng |
Dùng làm nhiên liệu, nguyên liệu chất khử trong công nghiệp hóa học
|
Dùng trong sản xuất nước giải khát gas bảo quản thực phẩm, dập tắt đám cháy.
|
LÝ THUYẾT HÓA HỮU CƠ
I. Phân loại hợp chất hữu cơ. Hợp chất hữu cơ gồm 2 loại
+ Hiđrocacbon: Chỉ chứa 2 nguyên tố là H, C.
+ Dẫn xuất của hiđrocacbon: Ngòai 2 nguyên tố H, C còn chứa các nguyên tố khác: N, O, Cl,...
II. Tính chất của hiđrocacbon.
| Metan | Etilen | Axetilen | Benzen | |
| CT cấu tạo | 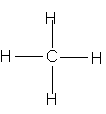 |
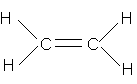 |
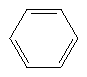 |
|
| T/c vật lý | Chất khí không màu, không mùi,ít tan trong nước | Chất lỏng,không màu,thơm, ít tan trong nước. | ||
| Phản ứng thế |
CH4 + Cl2
CH3Cl + HCl
|
Không phản ứng | Sẽ học ở lớp trên |
C6H6 + Cl2
C6H6 + Br2
C6H5Br + HBr
|
| P/ứ cộng | Không phản ứng |
C2H4 + H2
C2H4 + Br2 → C2H4Br2
|
C2H2 + H2
C2H4
C2H2 +H2
C2H6
|
C6H6 + 3Cl2
C6H6Cl6
|
| P/ứ trùng hợp | Không phản ứng |
nCH2=CH2
(-CH2-CH2-)n polietilen(PE)
|
Sẽ học ở lớp trên
|
hông phản ứng
|
| P/ứ cháy | CH4 + 2O2 |
C2H4 + 3O2
2CO2 + 2H2O
|
2C2H2 + 5O2
4CO2 + 2H2O
|
2C6H6 + 15O2
12CO2 + 6H2O
|
| P/ứ hợp nước | Không tham gia |
C2H4 + H2O
C2H5OH
|
Sẽ học ở lớp trên
|
Không tham gia
|
| Điều chế | CH3COONa + NaOH → CH4 + Na2CO3 |
C2H5OH → C2H4+ H2O
|
CaC2 + 2H2O → C2H2 + Ca(OH)2
|
3CHΞ CH → C6H6
|
| Ứng dụng |
Dùng làm nhiên liệu
-Sx bột than, H2, CCl4,
|
Kích thích quả mau chín, sx rượu, axit ,PE, ..
|
Dùng làm nhiên liệu, sx PVC, caosu, …
|
Làm dung môi, sx thuốc trừ sâu, chất dẻo,…
|
>>> Tải file tại đây: Tổng hợp Lý thuyết hóa học lớp 9 kì 1
B. Bộ đề thi giữa kì 1 Hóa 9
Đề thi giữa kì 1 Hóa 9 - Đề số 1
Câu 1. Dãy chất nào sau đây gồm các oxit tác dụng được với dung dịch NaOH?
A. BaO, Na2O, SO2
B. Fe2O3, BaO, ZnO
C. CO2, SO2, P2O5
D. ZnO, CaO, N2O5
Câu 2. Dùng chất nào sau đây để phân biệt được 2 chất bột Na2CO3 và Na2SO4
A. H2O
B. dung dịch HCl
C. dung dịch NaCl
D. CO2
Câu 3. Oxit bazơ nào sau đây được dùng để làm khô nhiều nhất?
A. CuO
B. Fe2O3
C. CaO
D. Na2O
Câu 4. Phản ứng giữa hai chất nà osauđây dùng để điều chế khí lưu huỳnh đioxit trong phòng thí nghiệm?
A. Na2SO3 và H2SO4
B. Na2SO3 và Ca(OH)2
C. S và O2 (đốt S)
D. FeS2 và O2 (đốt quặng pirit sắt)
Câu 5. Cặp chất nào sau đây không thể cùng tồn tại trong một dung dịch?
A. HCl, KCl
B. K2SO4 và AgNO3
C. H2SO4 và BaO
D. NaNO3 và H2SO4
Câu 6. Kim loại X tác dụng với HCl loãng giải phóng khí Hiđro. Dẫn toàn bộ lượng khí H2 trên qua ống nghiệm chứa oxit, nung nóng thu được kim loại Y. Hai chất X, Y lần lượt là:
A. Ca và Al
B. Mg và Fe
C. Na và Mg
D. Al và Cu
Câu 7. Dãy chất nào sau đây gồm bazơ bị nhiệt phân hủy là?
A. Fe(OH)3, Ca(OH)2, KOH, Cu(OH)2
B. NaOH, Fe(OH)2, Ba(OH)2, Mg(OH)2
C. NaOH, BaOH)2, Cu(OH)2, Al(OH)3
D. Fe(OH)3, Cu(OH)2, Mg(OH)2, Zn(OH)2
Câu 8. Dẫn từ từ 1,12 lít CO2 (đktc) vào 200 ml dung dịch NaOH 0,2M. Sau phản ứng thu được muối
A. Na2CO3
B. Na2CO3 và NaHCO3
C. NaHCO3
D. NaHCO3, CO2
Câu 9. Cặp chất khi phản ứng tạo ra chất khí là.
A. Na2CO3 và HCl
B. AgNO3 và BaCl2
C. K2SO4 và BaCl2
D. NaOH và Fe(NO3)3
Câu 10. Để làm sạch khí N2 từ hỗn hợp khí gồm N2, SO2, có thể dùng dung dịch nào sau đây?
A. H2SO4
B. Ca(OH)2
C. NaHSO3
D. CaCl2
Câu 11. Dãy gồm các chất phản ứng được với H2SO4 đặc nóng
A. Ag, Mg(OH)2, CaO và Na2CO3
B. Fe, Cu(OH)2, CO2 và Na2SO4
C. Ag, CO2, P2O5 và Na2SO4
D. Au, Mg(OH)2, P2O5 và S
Câu 12. Cho 9,75 gam Kẽm tác dụng với dung dịch H2SO4 loãng dư. Thể tích khí Hidro thoát ra (Đktc) là bao nhiêu lít?
A. 2,24 lít
B. 4,48 lít
C. 1,12 lít
D. 3,36 lít
II. TỰ LUẬN (6đ)
Câu 1. (2đ). Hoàn thành chuỗi phản ứng hóa học sau và ghi rõ điều kiện (nếu có)
Na → Na2O → NaOH → Na2CO3 → NaCl → NaOH → NaHCO3
Câu 2. (2đ) Có 4 lọ mất mất nhãn, đựng trong lọ riêng biệt là dung dịch không màu: HCl, Na2CO3, CaCl2, AgNO3. Chỉ được dùng quì tím, hãy nhận biết các dung dịch trên. Viết các phương trình hóa học xảy ra.
Câu 3. (2đ) Dung dịch X chứa 9,4 gam K2O và 190,6 gam nước. Cho X vào 200g dung dịch CuSO4 16% thu được m gam kết tủa .
a. Tính nồng độ phần trăm của X.
b. Tính m.
c. Tính lượng dung dịch HCl 2M cần dùng để hòa tan hết m gam kết tủa sau khi đã nung thành chất rắn đen.
........................HẾT....................
Đề thi giữa kì 1 Hóa 9 - Đề số 2
I. CÂU HỎI TRẮC NGHIỆM KHÁCH QUAN (4đ)
Chọn đáp án đúng nhất trong các câu hỏi dưới đây (0,25đ)
Câu 1. Trong các dãy oxit dưới đây, dãy nào thỏa mãn điều kiện tất cả các oxit đều phản ứng với axit clohiđric?
A. CuO, Fe2O3, CO2
B. CuO, P2O5, Fe2O3
C. CuO, SO2, BaO
D. CuO, BaO, Fe2O3
Câu 2. 0,1 mol FeO tác dụng vừa đủ với:
A. 0,2 mol HCl
B. 0,1 mol HCl
C. 0,05 mol HCl
D. 0,01 mol HCl
Câu 3. Cho a gam SO3 tác dụng với một lượng nước lấy dư, thu được 2,94 gam axit. Giá trị của a gam là:
A. 2,4 gam
B. 0,24 gam
C. 1,2 gam
D. 0,12 gam
Câu 4. CaO dùng làm chất khử chua đất trồng là ứng dụng tính chất hóa học gì của CaO?
A. Tác dụng với axit
B. Tác dụng với bazơ
C. Tác dụng với oxit axit
D. Tác dụng với muối
Câu 5. Để nhận biết 3 khí không màu: SO2, O2, H2 đựng trong 3 lọ mất nhãn ta dùng
A. Giấy quỳ tím ẩm
B. Giấy quỳ tím ẩm và dùng que đóm cháy dở còn tàn đỏ
C. Than hồng trên que đóm
D. Dẫn các khí vào nước vôi trong
Câu 6. Dung dịch H2SO4 tác dụng với chất nào tạo ra khí hiđro?
A. NaOH
B. Fe
C. CaO
D. CO2
Câu 7. Dãy các chất tác dụng được với dung dịch H2SO4 loãng tạo thành sản phẩm có chất khí:
A. BaO, Fe, CaCO3
B. Al, MgO, KOH
C. Na2SO3, CaCO3, Zn
D. Zn, Fe2O3, Na2SO3
Câu 8. Khi nhỏ từ từ H2SO4 đậm đặc vào đường chứa trong cốc hiện tượng quan sát được là:
A. Sủi bọt khí, đường không tan.
B. Màu trắng của đường mất dần, không sủi bọt.
C. Màu đen xuất hiện và có bọt khí sinh ra.
D. Màu đen xuất hiện, không có bọt khí sinh ra.
Câu 9. Chất nào dưới đây không dùng để phân biệt dung dịch Na2SO4 và dung dịch H2SO4loãng?
A. Mg
B. Mg(OH)2
C. MgO
D. Cu
Câu 10. Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Câu 11. Hòa tan 30 g NaOH vào 170 g nước thì thu được dung dịch NaOH có nồng độ là:
A. 18%
B. 16%
C. 15%
D. 17%
Câu 12. Cho dung dịch axit sunfuric loãng tác dụng với muối natrisunfit (Na2SO3). Chất khí nào sinh ra?
A. Khí hiđro
B. Khí oxi
C. Khí lưu huỳnhđioxit
D. Khí hiđro sunfua
Câu 13. Để làm sạch dung dịch đồng nitrat Cu(NO3)2 có lẫn tạp chất bạc nitrat AgNO3. Ta dùng kim loại:
A. Ag
B. Cu.
C. Fe.
D. Au.
Câu 14. Muối nào dưới đây bị nhiệt phân hủy
A. NaCl
B. FeS2
C. KNO3
D. CuCl2
Câu 15. Ứng dụng nào dưới đây không phải là ứng dụng của NaCl
A. Chế tạo thuốc nổ đen
B. Gia vị và bảo quan thực phẩm
C. Làm nguyên liệu sản xuất NaOH
D. Làm nguyên liệu cơ bản cho nhiều ngành công nghiệp hóa chất.
Câu 16. Loại phân đạm có hàm lượng nitơ cao nhất là
A. (NH4)2SO4
B. NH4NO3
C. CO(NH2)2
D. NH4Cl
II. Tự luận (6 điểm)
Câu 1. Hoàn thành chuỗi phản ứng hóa học sau:
FeS2 → SO2 → SO3 → H2SO4 → ZnSO4 → Zn(OH)2 → ZnO
Câu 2. Chỉ dùng thêm quỳ, nhận biết các dung dịch không màu: NaCl, H2SO4, BaCl2, KOH được đựng riêng biệt trong các lọ.
Câu 3. Trộn 30 ml dung dich chứa 2,22 gam CaCl2 với 70 ml dung dịch có chứa 1,7 gam AgNO3.
a) Hãy cho biết hiện tượng quan sát được khi trộn 2 dung dịch trên và viết phương trình hóa học của phản ứng
b) Tính khối lượng kết tủa thu được.
........................HẾT....................
Đề thi giữa kì 1 Hóa 9 - Đề số 3
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (4đ)
Chọn đáp án đúng nhất trong các câu hỏi dưới đây (0,25đ)
Câu 1. Dãy chất nào dưới đây gồm các oxit tác dụng được với dung dịch HCl?
|
A. CaO, Na2O, SO2
|
B. FeO, CaO, MgO
|
|
C. CO2, CaO, BaO
|
D. MgO, CaO, NO
|
Câu 2. Cho các chất sau: H2O, Na2O, CO2, CuO và HCl. Số cặp chất phản ứng được với nhau là:
|
A. 4
|
B.5
|
C.6
|
D.3
|
Câu 3. Oxit bazơ nào sau đây được dùng để làm khô nhiều nhất?
|
A. CuO
|
B. FeO
|
C. CaO
|
D. ZnO
|
Câu 4. Phản ứng giữa hai chất nào dưới đây không tạo thành khí lưu huỳnh đioxit?
A. Na2SO3 và HCl
B. Na2SO3 và Ca(OH)2
C. S và O2 (đốt S)
D. FeS2 và O2 (đốt quặng pirit sắt)
Câu 5. Để phân biệt 2 dung dịch H2SO4 loãng và HCl ta dùng hóa chất nào sau đây?
|
A. BaO
|
B. Al
|
C. K2O
|
D. NaOH
|
Câu 6. Cặp chất nào sau đây cùng tồn tại trong dung dịch?
A. HCl, KCl
B. HCl và Ca(OH)2
C. H2SO4 và BaO
D. NaOH và H2SO4
Câu 7. Kim loại X tác dụng với H2SO4 loãng giải phóng khí Hidro. Dẫn toàn bộ lượng hidro trên qua ống nghiệm chứa oxit, nung nóng thu được kim loại Y. Hai chất X, Y lần lượt là:
|
A. Ca và Zn
|
B. Mg và Ag
|
|
C. Na và Mg
|
D. Zn và Cu
|
Câu 8. Dãy dung dịch nào dưới đây không làm quỳ tím đổi thành màu xanh là:
A. NaOH, KOH, Cu(OH)2
B. NaOH, Ca(OH)2, Cu(OH)2
C. KOH, Fe(OH)2, Ca(OH)2
D. Cu(OH)2, Fe(OH)3, Mg(OH)2
Câu 9. Dãy chất gồm bazơ không bị nhiệt phân hủy là?
A. NaOH, Ca(OH)2, KOH, Cu(OH)2
B. KOH, Fe(OH)2, Ba(OH)2, Mg(OH)2
C. NaOH, CaOH)2, Ba(OH)2, KOH
D. KOH, Cu(OH)2, Mg(OH)2, Zn(OH)2
Câu 10. Dẫn từ từ 1,12 lít CO2 (đktc) vào 250 ml dung dịch NaOH 0,2M. Sau phản ứng thu được muối
|
A. Na2CO3
|
B. Na2CO3 và NaHCO3
|
|
C. NaHCO3
|
D. NaHCO3, CO2
|
Câu 11. Cặp chất khi phản ứng không tạo ra chất kết tủa.
A. Na2CO3 và HCl
B. AgNO3 và BaCl2
C. K2SO4 và BaCl2
D. BaCO3 và HCl
Câu 12. Để làm sạch khí O2 từ hỗn hợp khí gồm CO2, SO2 và O2, có thể dùng dung dịch nào sau đây?
|
A. H2SO4
|
B. Ca(OH)2
|
|
C. NaHSO3
|
D. CaCl2
|
Câu 13. Vôi sống có công thức hóa học nào sau đây?
|
A. CaO
|
B. CaCO3
|
|
C. Ca(OH)2
|
D. Ca(HCO3)2
|
Câu 14. Ứng dụng chính của lưu huỳnh đioxit là gì?
A. Sản xuất lưu huỳnh
B. Sản xuất O2
C. Sản xuất H2SO4
D. Sản xuất H2O
Câu 15. Cho 6,5 gam Kẽm tác dụng với dung dịch HCl dư. Thể tích khí Hidro thoát ra (Đktc) là bao nhiêu lít?
|
A. 2,24 lít
|
B. 4,48 lít
|
C. 1,12 lít
|
D. 3,36 lít
|
Câu 16. Dãy gồm chất tác dụng được với dung dịch CuCl2 là
A. NaOH, K2SO4 và Zn
B. NaOH, AgNO3 và Zn
C. K2SO4, KOH và Fe
D. HCl, Zn và AgNO3
II. TỰ LUẬN (6đ)
Câu 1. (2đ). Hoàn thành chuỗi phản ứng hóa học sau và ghi rõ điều kiện (nếu có)
S → SO2 → SO3 → H2SO4 → SO2 → H2SO3 → Na2SO3 → SO2
Câu 2. (2đ) Có 4 lọ mất mất nhãn, đựng trong lọ riêng biệt là dung dịch không màu: HCl, H2SO4, KCl, K2SO4. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra.
Câu 3. (2đ) Hòa tan 8 gam CuO trong 100 gam dung dịch H2SO4 19,6%.
a) Viết phương trình hóa học của phản ứng.
b) Tính nồng độ phần trăm của các chất trong dung dịch thu được
........................HẾT....................
>>> Tải file tại đây: Bộ đề thi giữa kì 1 Hóa 9
Trên đây là toàn bộ tài liệu ôn tập lý thuyết Hóa học lớp 9 giữa học kì 1 và Bộ đề thi giữa kì 1 hóa 9 năm học 2022 - 2023 mà các bạn có thể tham khảo. Hy vọng rằng sẽ có ích trong quá trình ôn tập. Ngoài ra, các bạn có thể làm full bộ đề Hóa 9 với các mức độ từ dễ đến nâng cao trong tủ sách tham khảo lớp 9 tại đây.
Trên đây là toàn bộ tài liệu ôn tập lý thuyết Hóa học lớp 9 giữa học kì 1 và Bộ đề thi giữa kì 1 hóa 9 năm học 2022 - 2023 mà các bạn có thể tham khảo. Hy vọng rằng sẽ có ích trong quá trình ôn tập. Ngoài ra, các bạn có thể làm full bộ đề Hóa 9 với các mức độ từ dễ đến nâng cao trong tủ sách tham khảo lớp 9 tại đây.












